Autor del artículo: G. Espino (Universidad de Burgos).
Las antocianinas son pigmentos naturales solubles en agua que se encuentran en las vacuolas celulares de prácticamente todos los tejidos vegetales (hojas, flores, frutos, tallos y raíces). Desde un punto de vista químico, las antocianinas son los glicósidos [1] de las antocianidinas. Éstas, por su parte, son compuestos polifenólicos derivados del catión flavilio [2] y pertenecen a una clase superior de moléculas llamadas flavonoides (ver Esquema 1). Algunas antocianidinas comunes se muestran en el Esquema 2.
Estos productos
naturales tienen funciones muy variadas en las plantas:
Las antocianinas son pigmentos naturales solubles en agua que se encuentran en las vacuolas celulares de prácticamente todos los tejidos vegetales (hojas, flores, frutos, tallos y raíces). Desde un punto de vista químico, las antocianinas son los glicósidos [1] de las antocianidinas. Éstas, por su parte, son compuestos polifenólicos derivados del catión flavilio [2] y pertenecen a una clase superior de moléculas llamadas flavonoides (ver Esquema 1). Algunas antocianidinas comunes se muestran en el Esquema 2.
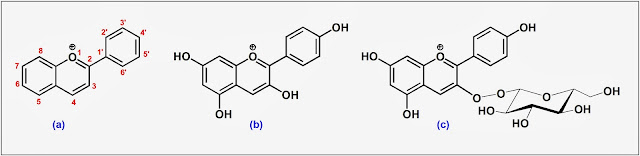 |
| Esquema 1. (a) Catión flavilio: estructura general y numeración; (b) Pelargonidina (antocianidina); (c) Pelargonidina-3-O-glucósido (antocianina). |
 |
| Esquema 2. Estructura molecular de algunas antocianidinas comunes. |
- En los tejidos fotosintéticos (hojas y tallos), las antocianinas ofrecen protección frente a la radiación ultravioleta, gracias a su capacidad para absorber no solo las frecuencias de radiación roja y azul en el visible, sino también la radiación ultravioleta.
- En las flores, constituyen una adaptación para atraer a los insectos gracias a sus llamativos tonos rojos y púrpuras, con el propósito de que éstos puedan facilitar la polinización.
- En los frutos, sus llamativos colores representan una llamada de atención para los animales favoreciendo la dispersión de sus semillas.
- En los árboles con hojas atípicas de color rojo, a las antocianinas se les atribuye una función de camuflaje frente a los herbívoros que se sienten atraídos por el color verde de las plantas, pero que no pueden percibir la luz de color rojo.
Las
antocianinas son muy comunes en la naturaleza. Así por ejemplo, están presentes en numerosos frutos silvestres como las moras, las zarzamoras, las frambuesas, las fresas, los arándanos, los saúcos y las grosellas,
y también en otras frutas de colores rojos como las cerezas, las ciruelas, las uvas rojas (y el vino) y las manzanas rojas. Además, se han encontrado en las flores y hojas de infinidad de plantas y en tubérculos y hortalizas como la remolacha y la lombarda entre otros muchos productos vegetales. Tienen notables propiedades
beneficiosas para la salud, tales como naturaleza antioxidante y capacidad en la
captación de radicales libres, y como consecuencia se les atribuye una cierta
actividad anti-cancerígena, y beneficios en las funciones cerebral y cardíaca.
El caldo de la lombarda es un indicador del pH
Una de las propiedades más singulares de las antocianinas es su
capacidad para cambiar de color en función del pH,
mostrando una amplia gama de tonos, desde el rojo, pasando por el púrpura o el
azul, hasta el amarillo (al aumentar el pH), de modo que actúan como
indicadores naturales del pH. Esto es debido a que su
estructura experimenta una amplia variedad de transformaciones moleculares en función
de la concentración de protones.
Las antocianinas a pH ácido (típicamente pH < 4) adoptan una estructura de tipo oxonio (catión flavilio) [2] y presentan colores en la gama de los rojos intensos gracias a la conjugación extendida entre los dos fragmentos aromáticos que permite la absorción de luz visible con una longitud de onda variable (480 - 550 cm-1), dependiendo de los sustituyentes de los anillos. A pH en torno a 4-5, sin embargo, estas moléculas experimentan un ataque nucleofílico sobre el C2 por parte de una molécula de agua, y adoptan una configuración de tipo carbinol pseudobase carente de color debido a la ausencia de conjugación entre el fragmento monocíclico y el resto de la molécula, lo que impide la absorción de luz visible. Por encima de pH 5 vuelven a adquirir colores intensos en la gama de los azules, verdes y amarillos, gracias al predominio de conformaciones neutras o aniónicas con una fuerte conjugación (ver Esquema 3).
Las antocianinas a pH ácido (típicamente pH < 4) adoptan una estructura de tipo oxonio (catión flavilio) [2] y presentan colores en la gama de los rojos intensos gracias a la conjugación extendida entre los dos fragmentos aromáticos que permite la absorción de luz visible con una longitud de onda variable (480 - 550 cm-1), dependiendo de los sustituyentes de los anillos. A pH en torno a 4-5, sin embargo, estas moléculas experimentan un ataque nucleofílico sobre el C2 por parte de una molécula de agua, y adoptan una configuración de tipo carbinol pseudobase carente de color debido a la ausencia de conjugación entre el fragmento monocíclico y el resto de la molécula, lo que impide la absorción de luz visible. Por encima de pH 5 vuelven a adquirir colores intensos en la gama de los azules, verdes y amarillos, gracias al predominio de conformaciones neutras o aniónicas con una fuerte conjugación (ver Esquema 3).
 |
| Esquema 3. Transformaciones moleculares en función del pH para la cianidina. |
En particular,
en la lombarda (Figura 1a) se han identificado 36 antocianinas diferentes, muchas
de ellas son glucósidos de la cianidina [3] (cianidin-3-O-glucósido, [1] cianidin-3,5-O-diglucósido,
cianidin
soforósido-glucósidos y muchos otros, ver Esquema 4). El color del caldo extraído al cocer una lombarda
varía con la concentración de protones desde el naranja hasta el
verde-amarillento, pasando por tonalidades rojas, rosas, azules y verdes al
aumentar el pH (ver Figura 1b).
 |
| Esquema 4. (a) cianidina; (b) crisantemina (cianidin-3-O-glucósido); (c) cianidin-3,5-O-diglucósido. |
Hortensias a la carta: azules, rosas o blancas
Otro ejemplo de la versatilidad de las antocianinas como pigmentos
naturales es la variedad de colores que presentan las hortensias. En este ejemplo, sin embargo, la clave no es el pH de las
flores que es muy similar para todos los colores, sino el pH del suelo y la presencia y movilización, o no, de
sales solubles de Al3+ en función del citado pH del suelo. Así, las hortensias florecen con un color azul cuando el pH del suelo es ácido (4,5-5), las flores
de color rosa se dan a pHs más altos (6-6,5), mientras que las flores de color blanco aparecen a pHs en torno a 8 (ver Figura 2).
 |
| Figura 2. Hortensias de color azul, rosa y blanco. (Fotos: G. Espino). |
Pero, ¿cómo puede el pH del suelo afectar al color de las flores? La respuesta está en la composición de los suelos arcillosos. Estos
suelos contienen minerales pertenecientes a la familia de los filosilicatos
de aluminio hidratados como la caolinita (Al2Si2O5(OH)4
= Al2O3·2SiO2·2H2O)). Dichos
minerales pueden liberar especies de Al3+
a pHs ácidos, gracias a la formación de complejos catiónicos solubles en agua
como los siguientes: [Al(OH2)6]3+,
[Al(OH2)5(OH)]2+
y [Al(OH2)4(OH)2]
+ (ver Esquema 5). En suelos más alcalinos sin embargo, el Al3+
de las arcillas permanece inmovilizado en forma de especies insolubles como los propios silicatos de alumninio, o bien óxidos o hidróxidos de este metal (de modo simplificado en las ecuaciones: “Al(OH)3(H2O)3”).
 |
| Esquema 5. Equilibrios ácido-base que explican la mobilización de especies de Al3+ en forma de complejos catiónicos solubles en agua a pH ácido. |
 |
| Esquema 6. (a) Delfinidina (antocianidina) (b) Mirtilina (3-O-glucósico de la delfinidina); (c) Tulipanina (3-O-rutinósido de la definidina) presente en las flores de diversas especies. [4] |
Como resultado de todo esto, el color de las hortensias puede controlarse modificando el pH del suelo, siempre y cuando haya cationes de Al3+ en el mismo. De modo que para transformar hortensias azules en hortensias rosas es preciso alcalinizar el suelo, normalmente utilizando cal (CaO, que reacciona con el agua para dar Ca(OH)2, y por lo tanto aniones OH-, ver Esquema 7, ecuaciones (1) y (2)). Esta variación del pH provoca la inmovilización de los cationes Al3+, evitando la formación del complejo con la mirtilina, y provocando el cambio de color deseado. A la inversa, para obtener hortensias azules a partir de flores rosas, es necesario acidificar el suelo, lo cual suele hacerse añadiendo Al2(SO4)3, ya que las disoluciones acuosas de esta sal son ácidas debido a la hidrólisis del catión metálico (ver Esquema 7, ecuación (3)). El sulfato de aluminio además tiene la ventaja adicional de aumentar la concentración de cationes Al3+ disponibles.
 |
| Esquema 7. Equilibrios de hidratación de la cal, de disociación del Ca(OH)2 y de hidrólisis del catión Al3+. |
Los glucósidos de la cianidina también contribuyen a los tonos rojizos de muchas frutas como las moras, las fresas, las cerezas, las manzanas rojas, las uvas rojas y el vino, y también de algunas flores como las rosas rojas (Figura 3a), pero además proporcionan su color azul a la flor del aciano o azulejo (centaura cyanus) (Figuras 3b). Como en otras antocianinas los colores de la cianidina y sus glucósidos también dependen del pH y de la presencia o no de metales. En el caso particular de la flor del azulejo el color azul se debe a la formación de un complejo supermolecular de la protocianina (antocianina de la cianidina) con hierro, magnesio y calcio, mientras que en las rosas rojas la protocianina se encuentra libre.
 |
| Figura 3a. Rosa roja. (Foto G. Espino). |
Referencias:
(1) http://mylespower.co.uk/2012/04/06/homemade-ph-indicator/
(1) http://mylespower.co.uk/2012/04/06/homemade-ph-indicator/
(2) Yurkanis Bruice, P. Organic Chemistry, Bruice,
4ª Ed.
(3) Burrows, A.; Holman, J.; Parsons, A.; Pilling, G.; Price, G. Chemistry3:
introducing inorganic, organic and physical chemistry. 2009. 1st Ed.
[1] Glicósido: es una molécula en la que un azúcar está unido a otro grupo funcional a través de un enlace glicosídico. Glucósido: es un glicósido derivado de la D-glucosa o dextrosa, que a su vez es un monosacárido natural que se encuentra en las plantas y cuya fórmula empírica es C6H12O6.
[2] En realidad el catión flavilio se encuentra asociado con un anión que mantiene la neutralidad eléctrica. Si la acidificación se ha llevado a cabo con HCl, el anión será el Cl-.
[3] A pesar de su nombre la molécula de la cianidina no contiene grupos cianuro en su estructura.
[4] Rutinósido: es un glicósido derivado de la Rutinosa,
que es un disacárido presente en algunos flavonoides naturales.



