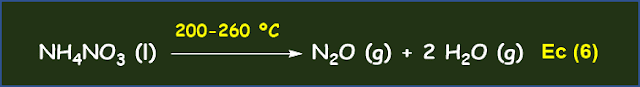Autor: Gustavo Espino Ordóñez
La dureza del agua se debe a la presencia de cationes de Ca2+ y Mg2+ en forma de sales solubles como Ca(HCO3)2, Mg(HCO3)2, CaCl2, MgCl2, o parcialmente solubles como CaSO4 y MgSO4. Este tipo de aguas presentan serios inconvenientes para su uso doméstico e industrial, aunque también pueden crear verdaderas maravillas naturales como las deslumbrantes terrazas de travertino típicas de Pamukkale en Turquía. El nombre del lugar no podría estar mejor escogido, ya que Pamukkale significa "castillo de algodón" en turco.
En este artículo se desvelan los procesos químicos que originan este tipo de aguas y se describen los problemas derivados de su uso, pero también se discuten algunas de las estrategias empleadas para su tratamiento, llamado descalcificación o ablandamiento y los procedimientos utilizados para destruir los depósitos calcáreos formados en tuberías, electrodomésticos e instalaciones industriales. Finalmente, se ofrece una interpretación geoquímica para el origen de las terrazas de travertino.
 |
| Figura 1. Terrazas de travertino (CaCO3) y piscinas naturales en Pamukkale (Turquía). Pinchar para ampliar. |
1. Origen de las aguas duras
La dureza del agua tiene su origen en la capacidad que tiene el agua de lluvia para disolver determinadas sales de calcio y magnesio cuando se filtra a través de depósitos minerales de rocas calizas y dolomíticas, pero también de yesos (CaSO4 ·2H2O) y de evaporitas que contienen CaCl2 y MgCl2. La dureza del agua se clasifica en dos categorías en función del tipo de sales que contiene: dureza temporal y dureza permanente.
2. Tipos de aguas duras y tratamientos
A) La dureza temporal del agua se debe a la disolución de los carbonatos de calcio y magnesio por parte del agua de lluvia enriquecida en CO2, lo que da lugar a su transformación en los correspondientes hidrogenocarbonatos solubles de Ca2+ (ej: Ca(HCO3)2) y Mg2+ (ej: Mg(HCO3)2) según las Ec (1) y (2).
 |
| Pinchar para ampliar. |
La naturaleza reversible de estos dos equilibrios y la reactividad de estas sales facilita la re-precipitación de sus cationes mediante calentamiento hasta ebullición (Ec (3), es decir la Ec (1) en sentido inverso) o por reación con cal apagada, Ca(OH)2 (ver Ec (4)):
 |
| Pinchar para ampliar. |
B) La dureza permanente del agua se debe a la presencia de determinadas sales de Ca2+ (ej: CaSO4 y CaCl2) y de Mg2+ (ej: MgSO4 y MgCl2) cuyo tratamiento por calentamiento hasta ebullición o con cal apagada no permite la precipitación de sus cationes. No obstante, la dureza permanente del agua se puede reducir o incluso eliminar mediante distintos procedimientos:
a) Precipitación de los cationes Ca2+
y Mg2+ en forma de carbonatos o fosfatos, gracias a un tratamiento con carbonatos de metales alcalinos (ver Ec (5) y
(6)) o con fosfato sódico (Ec (7)):
 |
| Pinchar para ampliar. |
b) Complejación con ácido cítrico, EDTA o polifosfatos (Na5P3O10), lo cual da lugar a la formación de complejos solubles de Ca2+
y Mg2+ que impiden la formación incrustaciones o residuos sólidos (ver más abajo).
c) Intercambio catiónico con resinas o zeolitas. En particular, las resinas orgánicas intercambiadoras de iones son muy eficientes, ya que permiten eliminar completamente todas las sales de las aguas duras. Típicamente, el agua dura se pasa a través de dos columnas:
- La primera columna contiene una matriz de poliestireno, cuyos fenilos están funcionalizados con grupos sulfónico (R-SO3H), de tal modo que al pasar el agua dura, los protones son intercambiados por los cationes del agua que quedan atrapados en la resina.
- La segunda columna contiene una matriz polimérica funcionalizada con grupos catiónicos de tipo amonio cuaternario y aniones hidroxilo interaccionando iónicamente con ellos (R-NMe3+OH-), de tal modo que son capaces de intercambiar los aniones OH- por los aniones hidrogenocarbonato, sulfato o cloruro.
 |
Figura 2. Procesos químicos típicos de las resinas de intercambio iónico en la descalcificación de aguas duras. Pinchar para ampliar. |
Estas resinas pueden ser regeneradas fácilmente pasando ácidos y bases, respectivamente, a través de las citadas columnas.
3. Inconvenientes de las aguas duras
Entre los principales inconvenientes de la dureza del agua se pueden destacar los siguientes:
- La formación de depósitos calcareos (fundamentalmente de CaCO3
y MgCO3) en teteras eléctricas y calentadores de agua a
nivel doméstico y en calderas de vapor y torres de refrigeración a nivel
industrial, todo lo cual puede provocar roturas y accidentes. Estos carbonatos son malos conductores del calor de modo que cuando se forman costras calcáreas es necesario sobrecalentar los elementos metálicos de las calderas para hacer hervir el agua y una eventual rotura de la costra puede provocar una explosión de vapor, debido a una ebullición repentina del agua.
- La obstrucción de tuberías y conducciones debido a la formación de incrustaciones calcareas.
- La pérdida de eficacia de los jabones y detergentes debido a la
formación de residuos sólidos insolubles de color blanco que
limitan la formación de espuma, tal y como ilustra la siguiente reacción
para el estearato sódico:
 |
| Pinchar para ampliar. |
 | |||||||||
| Figura 3. Incrustación calcárea en tubería. |
 |
| Figura 4. Depósito o costra calcárea en tetera eléctrica. |
 |
| Figura 5.Micrografía de un depósito calcáreo obtenida mediante microscopía de barrido electrónico (SEM). |
4. Destrucción de los depósitos calcáreos
Finalmente, debido a su naturaleza alcalina, las incrustaciones y depósitos calcáreos se pueden destruir con ácidos como el HCl (aq), de acuerdo con la siguiente reacción:
 |
| Pinchar para ampliar. |
5. Génesis geoquímica de las piscinas naturales de Pamukkale
Las terrazas, cascadas y piscinas naturales de Pamukkale, están formadas por estructuras de travertino, una forma natural de CaCO3 que precipita a partir de aguas geotermales ricas en Ca(HCO3)2. Por lo tanto, el travertino tiene una génesis hidrogeotérmica o geoquímica. Se cree que en dicho proceso hidrogeotérmico el agua de lluvia se filtra y percola a través de las zonas de fractura y de los sedimentos permeables de la corteza terrestre hasta entrar en contacto con el techo de una cámara magmática del manto, donde se calienta y disuelve gases como el CO2 debido a la enorme presión parcial de este último. El CO2 se forma como resultado de la descomposición térmica de los materiales calizos. Seguidamente, estas aguas geotermales ascienden desde sus reservorios, gracias a su menor densidad y a procesos convectivos y emergen a la superficie en surgencias o fuentes termales. En el trayecto disuelven los materiales calizos de acuerdo con la Ec (1). Finalmente, estas aguas supersaturadas en sales como Ca(HCO3)2 y también en CO2, al salir a la superficie, liberan este gas debido a que la presión parcial atmosférica de CO2 es muy baja. De modo que la concentración de CO2 en disolución disminuye hasta equilibrarse con la presión parcial de CO2 atmosférica, lo que implica un aumento del pH y provoca la precipitación del CaCO3 según la Ec (3).
 |
| Pinchar para ampliar. |
 |
| Figura 6. Depósitos de travertino blanco (CaCO3) de gran pureza en Pamukkale. Pinchar para ampliar. |
6. Bibliografía
(1) Holleman-Wiberg. Inorganic Chemistry. Nils Wiberg. Academic Press. First English Edition. 2001.
(2) Housecroft-Sharpe. Inorganic Chemistry. Fourth Edition.
(3) Hard water (wikipedia).
(4) Limescale (https://en.wikipedia.org/wiki/Limescale).
(5) Water softening (https://en.wikipedia.org/wiki/Water_softening).
(6) Nevzat Özgür et al. European Geologist 43, May 2017, pg. 53.